Baza je kemična spojina, ki jo sestavljajo OH–ione in sprejema protone. Baze v kemiji so tiste spojine, ki obarvajo rdeči lakmus modro in ko reagirajo s kislino, nevtralizirajo reakcijo, da nastane sol in voda. pH vrednost baze je večja od 7. Baze so grenkega okusa in spolzke na dotik. Baze, ki so topne v vodi, se imenujejo alkalije. Primeri baz so kovinski oksidi, kovinski hidroksidi itd. Milo je primer baze, ki jo uporabljamo v vsakdanjem življenju. V tem članku bomo podrobno spoznali definicijo, lastnosti in kemijske reakcije baz.
normalizacija rdbms

Osnovna definicija
Baza je definirana kot kemična spojina, katere pH vrednost je večja od 7, sprejme proton, nevtralizira kislino in obarva rdeč lakmus v modro. Na splošno sproščajo OH–ion ob disociaciji. Primeri vključujejo NaOH, NaHCO3,itd. Sledi nekaj splošnih značilnosti, ki jih prikazuje osnova:
- Imajo grenak okus
- Na dotik so spolzki
- Rdeči lakmus postanejo modri
- Osvobodijo OH–ion, ko je raztopljen v vodi
- Prevajajo električni tok v obliki raztopine
Baze so ena najpomembnejših kemičnih spojin, ki se uporabljajo v vsakdanjem življenju. Baze se uporabljajo kot antacid za uravnavanje kislosti in v zobni pasti za nevtralizacijo delovanja bakterij, ki proizvajajo kislino v naših ustih in preprečujejo degradacijo sklenine in kariesa. Uporabljajo se tudi kot pecilni prašek, soda bikarbona in pralni prašek.
Lewisova baza
Lewisove baze so spojine, ki imajo elektronski par in ga lahko oddajo spojinam, ki jim primanjkuje elektronskih parov. Lewisove baze so po naravi nukleofilne, tj. ljubijo jedra, kar pomeni, da bodo s svojimi elektronskimi pari napadle pozitivno nabit center. Primeri Lewisove baze vključujejo amoniak, ker v amoniaku (NH3) središčni atom dušika ima 5 elektronov, od katerih se 3 uporabijo za ustvarjanje vezi s 3 atomi vodika, en par elektronov pa ostane pri atomu N, kar tvori NH3baza Lewis.
Baza Arrhenius
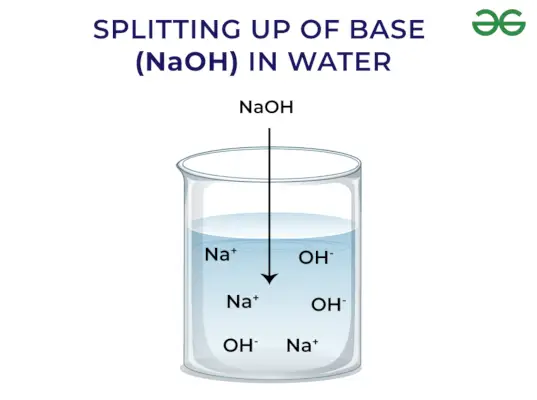
Po Arrheniusovem konceptu so baze spojine, ki sproščajo hidroksidne ione, ko se raztopijo v vodi in povečajo koncentracijo hidroksilnih ionov v vodni raztopini. Na primer, ko je KOH raztopljen v vodi, bo nastal OH–ion in s tem poveča koncentracijo OH–v vodi.
Baza Bronsted
Bronstedov koncept baze je napredna različica Arrheniusovega koncepta, ki pravi, da so baze spojine, ki sprejemajo H+ion ali proton, da tvorijo svojo konjugirano kislino. Na primer Cl–je osnova, ki sprejema H+da tvori HCl kot svojo konjugirano kislino.
Vrste baz
Baze lahko razvrstimo na podlagi kislosti, koncentracije in ionizacijske sposobnosti. Razvrstitev je navedena spodaj
Vrste baz glede na kislost
Kislost baze se nanaša na število zamenljivih hidroksilnih skupin, prisotnih v eni molekuli baze. Glede na kislost so baze razvrščene v tri kategorije:
- Monokislinska baza
- Diacidna baza
- Triacidna baza
Monokislinska: Monokislinske baze so tiste, ki vsebujejo le en zamenljiv hidroksilni ion in medsebojno delujejo samo z enim vodikovim ionom. Monokislinske baze vključujejo NaOH, KOH in druge.
Diacidni: Diacidna baza je baza z dvema zamenljivima hidroksilnima ionoma, ki medsebojno delujeta z dvema vodikovima ionoma. Ca(OH)2, Mg(OH)2, in druge dvokislinske baze so primeri.
trikislin: Trikislinska baza je vrsta baze, ki vsebuje tri zamenljive hidroksilne ione in tri vodikove ione. Trikislinske baze vključujejo Al(OH)3, Fe(OH)3, in drugi.
Vrste baz glede na njihovo koncentracijo v vodni raztopini
Koncentracija se nanaša na količino baze, prisotne v vodni raztopini. Baze glede na koncentracijo v vodni raztopini delimo v dve kategoriji:
- Koncentrirana baza
- Razredčena baza
Koncentrirana baza: Koncentrirane baze so tiste, v katerih je količina baze velika v primerjavi s topilom. Na primer koncentrirana raztopina NaOH.
Razredčena osnova: Te vrste baz imajo nižjo koncentracijo baze v svoji vodni raztopini. Redčenje je postopek zmanjševanja odstotka topljenca z dodajanjem večje količine topila. Na primer, razredčite NaOH, razredčite KOH itd.
Vrste baz glede na stopnjo ionizacije
Stopnja ionizacije se nanaša na sposobnost kemične spojine, da sprosti svoj sestavni ion, ko se raztopi v vodi. V primeru baze se stopnja ionizacije nanaša na sposobnost baze, da sprošča OH–ioni, ko so raztopljeni v vodi. Baze glede na stopnjo ionizacije delimo na dve vrsti:
- Močna podlaga
- Šibka osnova
Močna osnova: Močne baze so tiste baze, ki popolnoma disociirajo in sprostijo OH- ion, ko se raztopijo v vodi. Nekateri primeri močnih baz vključujejo NaOH, KOH itd.
Šibka osnova: Baze, ki niso podvržene popolni disociaciji in sprostijo le del OH-ionov, se imenujejo šibke baze. Primeri šibkih baz vključujejo Al(OH)3,Cu(OH)2,itd.
Nauči se več, Močne in šibke baze
Lastnosti baz
Ker vemo, da so baze kemične spojine, ki imajo ion OH-, obarvajo rdeč lakmus modro itd. V tem razdelku se bomo seznanili s fizikalnimi in kemijskimi lastnostmi baz skupaj z nekaj kratkimi informacijami o njihovih splošnih lastnostih.
Splošne lastnosti baze
Splošne lastnosti baz so navedene spodaj:
- Hidroksidni ion (OH–) se sprosti v vodo z bazami. Čim močnejša postane baza, ko se sprosti več ionov.
- Baze reagirajo s kislino in tvorijo sol Kisline reagirajo z bazami. To reakcijo baze s kislino imenujemo reakcija nevtralizacije.
- Osnove obarvajo rdeč lakmus v modro.
- Strukturo beljakovine lahko spremenijo baze. Podlage imajo to kakovost, zaradi česar so gladke. Milo je osnova, ki na mokri koži postane neverjetno spolzka. Zaradi svoje sposobnosti spreminjanja strukture beljakovin so nekatere močne baze izjemno nevarne.
Fizikalne lastnosti baz
Osnove grenkega okusa: Osnove so grenkega okusa. Zaradi grenkobe imamo le malo alkalnih živil. Obstaja le nekaj alkalnih živil. Baze je treba okušati bolj previdno kot kisline.
Podlage so spolzke na dotik: Ob dotiku so podlage spolzke. Na primer milo.
Baze sproščajo OH – Ion: Ko se baze raztopijo v vodi, sprostijo hidroksilni ion (OH–). Glede na sposobnost sproščanja hidroksilnih ionov jih delimo na močne in šibke.
Baze nevtralizirajo kisline: Ko baze reagirajo s kislinami, se nevtralizirajo in proizvajajo sol in vodo. Ta reakcija se imenuje Reakcija nevtralizacije . Recimo, da imamo kislino HY in bazo 'XOH', potem bo nastala sol 'XY'. Enačbo za to reakcijo lahko podamo kot HY + XOH → HOH + XY.
Baze denaturirajo beljakovine: Denaturacija beljakovin pomeni uničenje stabilnosti in strukture beljakovine. Zaradi tega je uporaba baze škodljiva za ljudi, saj so človeška koža in lasje sestavljeni iz beljakovin, in če se uporabljajo močne alkalije, kot sta natrijev ali kalijev hidroksid, imenovan tudi lug, povzročijo škodljiv vpliv na človeško kožo.
Osnove spremenijo rdeči lakmus v modro: Ko baze pridejo v stik z rdečim lakmusom, ga obarvajo modro. Vendar je treba opozoriti, da takšne spremembe ni mogoče opaziti, ko poskušamo reagirati na suho bazo z rdečim lakmusovim papirjem. Test z lakmusovim papirjem je ena najstarejših metod testiranja. Vendar obstajajo tudi drugi indikatorji, kot je fenolftalein
Baze prevajajo elektriko: Ko so baze v obliki raztopine, imajo mobilne OH-ione, zato lahko prevajajo elektriko.
Kemijske lastnosti baz
- Reakcija baze s kovinami: Ko alkalija (baza) reagira s kovino, nastane sol in vodikov plin.
Alkalije + kovina → sol + vodik
Primeri:
rdbms
- Pri interakciji natrijevega hidroksida s kovinskim aluminijem nastaneta natrijev aluminat in vodikov plin.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Ko natrijev hidroksid medsebojno deluje s kovino cinka, proizvede vodikov plin in natrijev cinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reakcija nekovinskih oksidov z bazo: Sol in voda nastaneta, ko nekovinski oksidi reagirajo z bazo.
Nekovinski oksid + baza → sol + voda
Ko kalcijev hidroksid, baza reagira z ogljikovim dioksidom, nato nastaneta kalcijev karbonat in voda.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Reakcija alkalij/baz z amonijevimi solmi: Amoniak nastane, ko alkalije reagirajo z amonijevimi solmi.
Alkalije + amonijeva sol → sol + voda + amoniak
Ko kalcijev hidroksid reagira z amonijevim kloridom, nastaneta voda kalcijevega klorida in amoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Primeri baz
Baze so na splošno kovinski oksid, kovinski hidroksid, kovinski hidrogen karbonat, kovinski karbonati itd. Oglejmo si nekaj primerov baz z njihovo uporabo v obliki tabele:
| Baze | Aplikacije |
|---|---|
| Kalijev hidroksid KOH | Uporablja se v alkalnih baterijah |
| Natrijev hidroksid NaOH | Uporablja se pri proizvodnji mila in detergentov |
| Magnezijev hidroksid Mg(OH) 2 | Uporablja se kot antacid |
| Natrijev bikarbonat NaHCO 3 dharmendra starost | Uporablja se kot soda bikarbona |
| Natrijev karbonat Že 2 CO 3 | Uporablja se kot pralna soda |
| amoniak NH 3 dekodiranje javascript base64 | Uporablja se v proizvodnji čistilnih in farmacevtskih izdelkov |
| Kalcijev hidroksid Ca(OH) 2 | Uporablja se pri belem pranju |
Uporaba baz
Obstajajo različni primeri uporabe baze, nekateri od teh so:
- Natrijev hidroksid se uporablja pri izdelavi mila in papirja. Natrijev hidroksid (NaOH) se uporablja tudi pri proizvodnji rajona.
- Belilni prašek je narejen iz Ca(OH)2, splošno znan kot gašeno apno ali kalcijev hidroksid.
- Kalcijev hidroksid se uporablja za ustvarjanje suhih mešanic za barvanje in dekoracijo.
- Magnezijev hidroksid, popularno znan kot magnezijevo mleko, je odvajalo, ki se pogosto uporablja. Uporablja se tudi kot antacid, saj zmanjšuje prekomerno kislost v človeškem želodcu.
- V laboratorijih je amonijev hidroksid kritičen reagent.
- Gašeno apno lahko uporabite za nevtralizacijo prekomerne kislosti tal.
Preberi več
- Kislina, baza in sol
- Jakost kisline
- Ionizacija kisline in baze
Pogosta vprašanja o osnovah kemije
1. Kaj so baze?
- Bazične spojine imajo grenak okus.
- Tekstura večine baz je milnasta.
- Pri testiranju na lakmusovem papirju v večini primerov spremeni rdeči lakmusov papir v modri lakmusov papir.
- V raztopini bazne spojine tudi prevajajo elektriko.
- Ko se bazne spojine raztopijo v vodi, se sprostijo OH- ioni.
2. Kakšne so funkcije baz?
Doma uporabljamo baze kot čistila in antacide. Mila, lug (ki se uporablja v čistilih za pečice), magnezijevo mleko in Tums so primeri priljubljenih domačih baz. Vsak od njih ima pH večji od sedem, lahko porablja prosti vodik in nevtralizira kisline.
3. Kakšna je najpomembnejša razlika med kislino in bazo?
Kisline in baze sta dve vrsti jedkih kemikalij. Kisli materiali imajo pH vrednost med 0 in 7, medtem ko imajo baze pH vrednost med 7 in 14. Kisline so ionske kemikalije, ki v vodi razpadejo, da ustvarijo vodikov ion (H+), medtem ko baza disociira, da dobi OH- ion.
4. Kakšne so fizikalne lastnosti baz?
- Imajo grenak okus.
- Njihove vodne raztopine imajo milo.
- Spremenijo barvo lakmusovega papirja iz rdeče v modro.
- Njihove vodne raztopine so električno prevodne.
- Ob sproščanju vodikovega plina baze reagirajo s kovinami in tvorijo sol.
5. Kaj se zgodi, ko kalcijev hidroksid reagira z amonijevim kloridom?
Ko kalcijev hidroksid reagira z amonijevim kloridom, nastaneta voda kalcijevega klorida in amoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Kaj se zgodi, ko natrijev hidroksid reagira s cinkovo kovino?
Ko natrijev hidroksid medsebojno deluje s kovino cinka, proizvede vodikov plin in natrijev cinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Kaj je Lewis Base?
Lewisova baza so spojine, ki oddajo par elektronov spojini s pomanjkanjem elektronov. Primer vključuje NH3.
8. Iz česa so izdelane baze?
Baze so na splošno sestavljene iz OH–ion. Poleg teh kovinskih oksidov so baze tudi karbonati in hidrogenkarbonati.
9. Kaj so alkalije?
Baze, ki so topne v vodi, se imenujejo alkalije. Primer je natrijev hidroksid NaOH.
10. Kaj sta močna in šibka osnova?
Baze, ki popolnoma disociirajo, da nastanejo OH–ione pri raztapljanju v vodi imenujemo močna baza. Primeri vključujejo NaOH. Šibke baze so tiste, ki ne disociirajo popolnoma, da bi sprostile OH–ion imenujemo šibka baza. Primeri šibkih baz vključujejo amonijev hidroksid.
