Atomske orbitale , ki so matematične funkcije, opisujejo valovno obnašanje elektronov (ali elektronskih parov) v atomu. Atomske orbitale imajo različne oblike glede na njihovo vrsto. Različne oblike atomskih orbital opisujejo, da obstaja največja ali nična verjetnost, da najdemo elektron okoli jedra v nekaterih smereh. Obstajajo štiri vrste orbital, vsaka ima drugačno obliko in jih predstavljajo črke s, p, d in f. Orbitali s in p sta upoštevani, ker ju je največ v kemijski in biološki kemiji. An s-orbitala ima v središču sferično jedro, a p-orbitala je v obliki ročice in štiri od petih d orbitale so v obliki deteljice. Peta d orbitala je oblikovana kot dolga ročica s krofom v sredini. Orbitale atoma so organizirane v plasti ali elektronske lupine.
Kaj so atomske orbitale?
Atomske orbitale so tridimenzionalni prostor v bližini jedra atoma, kjer je možnost odkritja elektrona največja.
Atom ima lahko po kvantnem atomskem modelu neskončno število orbital. Te orbitale je mogoče razvrstiti glede na njihovo velikost, obliko ali orientacijo. Ožja orbitala pomeni večjo verjetnost, da ujame elektron blizu jedra. Orbitalna valovna funkcija je pogosto znana kot matematična funkcija, ki se uporablja za izražanje koordinat elektrona. Verjetnost lociranja elektrona je predstavljena s kvadratom orbitalne valovne funkcije. Ta valovna funkcija pomaga tudi pri ustvarjanju diagramov mejnih površin.
Funkcija orbitalnih valov
The kvantni atomski model napoveduje, da ima lahko atom veliko različnih orbital. Te orbitale lahko razvrstimo v skupine glede na njihovo velikost, geometrijo ali naklon. Zmanjšana velikost orbite poveča verjetnost pridobitve elektrona blizu jedra. Matematična funkcija, ki se uporablja za predstavitev koordinat elektrona, se imenuje orbitalna valovna funkcija . Verjetnost odkritja elektrona je predstavljena s kvadratom orbitalne valovne funkcije.
To valovno funkcijo lahko uporabimo tudi za ustvarjanje diagramov mejnih površin. Obliko orbital lahko bolje razumemo z uporabo diagramov mejne površine konstantne gostote verjetnosti za različne orbitale.
okvir tkinter
Oblike atomskih orbital
Oblike atomskih orbital se razlikujejo. To pomeni, da so verjetnostne porazdelitve elektronov, ki jih opisujejo okoli jedra, različne. Dejstvo, da se elektroni v različnih orbitalah verjetno nahajajo na različnih območjih okoli starševskega jedra in zato doživljajo privlačnost slednjega z različnimi močmi, je eden od razlogov, zakaj se orbitale razlikujejo po energiji. Presenetljivo je, da imajo vse orbitale v dani lupini vodikovega atoma enako energijo, medtem ko imajo različne oblike. To je posledica izločanja različnih prispevkov, povezanih z energijo.
Toda takoj ko se pojavi drugi elektron, degeneracija izgine.
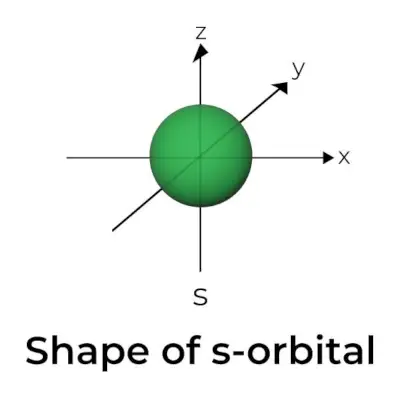
Oblika s-orbitale
- Diagram orbitalne mejne površine je podoben krogli z jedrom v središču, ki ga je mogoče prikazati v dveh dimenzijah kot krog.
- s-orbitale so sferično simetrične, kar pomeni, da je verjetnost, da najdemo elektron na določeni razdalji, enaka v vseh smereh.
- Velikost orbitale s se prav tako povečuje, ko se povečuje vrednost primarnega kvantnega števila (n); torej 4s> 3s> 2s> 1s.
- Nodalna točka je lokacija, kjer ni možnosti, da bi našli elektron. Vozlišča so razvrščena v dve vrsti: radialna vozlišča in kotna vozlišča. Oddaljenost od jedra izračunamo z radialnimi vozlišči, orientacijo pa določimo s kotnimi vozlišči.
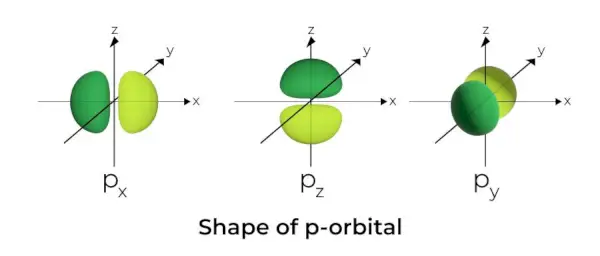
Oblika p-orbitale
- P orbitale so oblikovane kot dumbbeli.
- Orbitalno vozlišče p se nahaja v središču jedra.
- Zaradi prisotnosti treh orbital lahko p orbitala zasede največ šest elektronov.
- Vsaka p orbitala je sestavljena iz dveh delov, znanih kot reženj, ki se nahajata na obeh straneh ravnine, ki poteka čez jedro.
- Vsaka p orbitala ima dele, znane kot režnjevi, na obeh straneh ravnine, ki poteka čez jedro. Na ravnini, kjer se režnja sekata, je verjetnost, da najdemo elektron, nična.
- Tri orbitale so znane kot degenerirane orbitale, ker imajo enako velikost, obliko in energijo.
- Edina razlika med orbitalami je orientacija režnjev. Ker so režnjevi usmerjeni vzdolž osi x, y ali z, se imenujejo 2px, 2pyin 2pz. Za izračun števila vozlišč se uporablja formula n –2.
- Podobno kot pri s orbitalah, se velikost in energija p orbital povečata z večanjem primarnega kvantnega števila (4p> 3p> 2p).
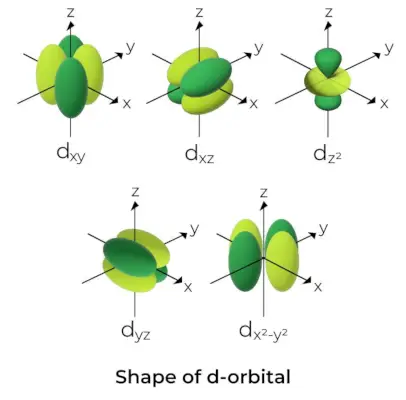
Oblika d-orbitale
- Za d orbitale je magnetno orbitalno kvantno število podano kot (-2,-1,0, 1,2). Posledično lahko trdimo, da obstaja pet d-orbital.
- Te orbitale so označene s simboli dxy, dyz, dxz, dx2-in2, in dz2.
- Oblike prvih štirih d orbital so si podobne, kar se razlikuje od dz2orbitala, vendar je energija vseh petih d orbital enaka.
Oblika f-orbitale
- Oblika f orbitale je razpršena. Ker je vrednost l=3 za orbitalo f, je minimalna vrednost primarnega kvantnega števila n 4.
- Ekvivalentne vrednosti ml za orbitalo f so (-3,–2, –1, 0, +1, +2, +3).
- Posledično obstaja sedem f orbital za l = 3.

ime posebnih znakov
Degenerirane orbitale
Degenerirane orbitale so tiste z enako energijo. Te orbitale so različne (lahko so različno usmerjene v prostoru okoli atomsko jedro ), vendar imata enako energijo. V prisotnosti zunanjega polja degeneracija orbitale p ni prizadeta; vendar se lahko degeneracija f in d orbital prekine z uporabo zunanjega polja na sistem (električnega ali magnetnega polja).
Nekaj orbital bo imelo večjo energijo, druge pa manjšo. Degeneracije v sistemu ne bo več. Na primer, d orbitale so sestavljene iz petih degeneriranih orbital, ki imajo vse enako energijo.
Preberi več:
- Teorija molekularne orbite
- Polnjenje orbitale v atomu
- Hibridizacija
Pogosta vprašanja o oblikah atomskih orbital
Vprašanje 1: Kako delujejo orbitale?
odgovor:
rudyard kipling če razlaga
Atomska orbitala je matematični izraz, ki izraža valovito obnašanje enega elektrona ali para elektronov v atomu v atomski teoriji in kvantni mehaniki. Vsaka orbitala bo prevzela največ dva elektrona, vsak s svojo količino spina.
2. vprašanje: Kaj je nodalna ravnina?
odgovor:
Ravnina, kjer je verjetnost najdbe elektrona zanemarljiva ali enaka nič, se imenuje Nodalna ravnina.
Vprašanje 3: Koliko je orbital?
odgovor:
Ker ima podnivoj s samo eno orbitalo, sta lahko prisotna samo dva elektrona. Ker podnivo p obsega tri orbitale, je lahko prisotnih največ šest elektronov. Ker podnivo d obsega 5 orbital, je lahko prisotnih največ 10 elektronov. In vsaka od štirih podravni ima sedem orbital, ki lahko vsebujejo največ 14 elektronov.
delna diferenciacija v lateksu
Vprašanje 4: Katere orbitale imajo največjo energijo?
odgovor:
algoritem za razvrščanje vstavljanja
Orbitalne 1s imajo največ energije. Energija elektrona je količina energije, ki je potrebna, da ga izvlečemo iz električnega mehurčka atoma.
Vprašanje 5: Kakšna je razlika med lupino in orbitalo?
odgovor:
V atomu je lupina zbirka podlupin iste kvantne teorije števil, n. Vsaka orbitala ima dva elektrona in elektroni v isti orbitali imajo enako definicijo velikosti, velikosti kotne količine in magnetnega kvantnega števila.
Vprašanje 6: Kaj je sigma in pi vez?
odgovor:
Prekrivanje atomskih orbital ustvarja sigma in pi vezi. Sigma vezi nastanejo s prekrivanjem atomskih orbitalnih reženj, medtem ko Pi vezi nastanejo, ko en atomski orbitalni reženj prekriva drugega.
