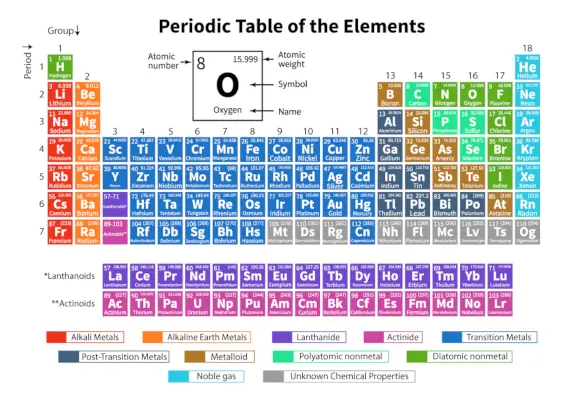
The Periodni sistem elementov je sistematična razporeditev 118 znanih kemičnih elementov. Ti kemični elementi so organizirani po naraščajočem atomskem številu. Vodoravne vrstice od leve proti desni se imenujejo obdobja, navpične stolpce od zgoraj navzdol pa skupine v periodnem sistemu.
Kazalo
- Kaj je periodni sistem?
- Seznam elementov periodnega sistema
- Pomembni izrazi v periodnem sistemu
- Razvrstitev elementov v periodnem sistemu
- Mendelejev periodni sistem
- Pogosta vprašanja o periodnem sistemu elementov
Kaj je periodni sistem?
Periodni sistem je tabelarični prikaz, v katerem so vsi znani kemijski elementi razporejeni v vodoravne vrstice, imenovane obdobja, in navpične stolpce, imenovane skupine, ki temeljijo na njihovi atomsko število oziroma atomsko strukturo.
Je razporeditev vseh znanih elementov in zato zagotavlja informacije o elementih, kot so njihova masa, število elektronov, konfiguracija elektronov in njihove edinstvene kemijske lastnosti.
Seznam elementov periodnega sistema
Tukaj je tabela, ki predstavlja 118 elementov periodnega sistema. Našteti elementi so razvrščeni glede na naraščajoči vrstni red atomskega števila in njihove ustrezne atomske teže, simbola, gostote in elektronegativnosti.
| Elementi v periodnem sistemu z atomsko maso | |||||
|---|---|---|---|---|---|
| Atomsko število | Ime kemijskega elementa | Simbol | Atomska masa (amu) | Gostota (g/cm 3 ) | Elektronegativnost |
| 1 | vodik | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Helij | On | 4,0026 | 0,0001785 | – |
| 3 | Litij | to | 6,941 | 0,534 | 0,98 |
| 4 | Berilij | bodi | 9,0122 | 1,85 | 1.57 |
| 5 | bor | B | 10.811 | 2.34 | 2.04 |
| 6 | Ogljik | C | 12.0107 | 2,267 | 2.55 |
| 7 | Dušik | n | 14.0067 | 0,0012506 | 3.04 |
| 8 | kisik | O | 15,9994 | 0,001429 | 3.44 |
| 9 | Fluor | F | 18,9984 | 0,001696 | 3,98 |
| 10 | Neon | ja | 20.1797 | 0,0009002 | – |
| enajst | Natrij | Že | 22,9897 | 0,968 | 0,93 |
| 12 | magnezij | Mg | 24,305 | 1,738 | 1.31 |
| 13 | Aluminij | Za | 26,9815 | 2.7 | 1.61 |
| 14 | Silicij | ja | 28.0855 | 2,329 | 1.9 |
| petnajst | fosfor | p | 30.9738 | 1,823 | 2.19 |
| 16 | Žveplo | S | 32.065 | 2.07 | 2.58 |
| 17 | Klor | Cl | 35,453 | 0,0032 | 3.16 |
| 18 | Argon | z | 39.948 | 0,001784 | – |
| 19 | kalij | K | 39,0983 | 0,89 | 0,82 |
| dvajset | kalcij | to | 40.078 | 1.55 | 1 |
| enaindvajset | skandij | sc | 44,9559 | 2,985 | 1.36 |
| 22 | Titan | od | 47.867 | 4,506 | 1.54 |
| 23 | vanadij | IN | 50,9415 | 6.11 | 1.63 |
| 24 | Chromium | Kr | 51,9961 | 7.15 | 1.66 |
| 25 | Mangan | Mn | 54.938 | 7.21 | 1.55 |
| 26 | Železo | vera | 55.845 | 7,874 | 1.83 |
| 27 | Kobalt | Co | 58.9332 | 8.9 | 1,88 |
| 28 | Nikelj | noter | 58.6934 | 8,908 | 1.91 |
| 29 | baker | z | 63.546 | 1.9 | 60 |
| 30 | Cink | Zn | 65.39 | 1.65 | 70 |
| 31 | Galij | Tukaj | 69.723 | 1.81 | 19 |
| 32 | Germanij | Ge | 72,64 | 2.01 | 1.5 |
| 33 | arzen | Kot | 74.9216 | 2.18 | 1.8 |
| 3. 4 | Selen | ON | 78,96 | 2.55 | 0,05 |
| 35 | Brom | Br | 79.904 | 2.96 | 2.4 |
| 36 | kripton | NOK | 83.798 | 3 | 1×10−4 |
| 37 | Rubidij | Rb | 85.4678 | 0,82 | 90 |
| 38 | Stroncij | Sr | 87,62 | 0,95 | 370 |
| 39 | Itrij | IN | 88.906 | 1.22 | 33 |
| 40 | Cirkonij | Zr | 91.224 | 1.33 | 165 |
| 41 | Niobij | Nb | 92.906 | 1.6 | dvajset |
| 42 | molibden | Mo | 95,94 | 2.16 | 1.2 |
| 43 | tehnecij | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Rutenij | Ru | 101.07 | 2.2 | 0,001 |
| Štiri | Rodij | Rh | 102.91 | 2.28 | 0,001 |
| 46 | paladij | Pd | 106.42 | 2.2 | 0,015 |
| 47 | Srebrna | pri | 107,87 | 1.93 | 0,075 |
| 48 | kadmij | Cd | 112,411 | 1,69 | 0,159 |
| 49 | Indij | noter | 114,82 | 1.78 | 0,25 |
| petdeset | Verjeti | Sn | 118.71 | 1.96 | 23 |
| 51 | Antimon | Sb | 121,76 | 2.05 | 0,2 |
| 52 | Telur | The | 127.6 | 2.1 | 0,001 |
| 53 | jod | jaz | 126.9045 | 2.66 | 0,45 |
| 54 | Ksenon | avto | 131.293 | 2.6 | 3×10−5 |
| 55 | cezij | Cs | 132,91 | 0,79 | 3 |
| 56 | Barij | ne | 137.327 | 0,89 | 425 |
| 57 | Lantan | The | 138,91 | 1.1 | 39 |
| 58 | Cerij | to | 140.12 | 1.12 | 66.5 |
| 59 | Prazeodim | Pr | 140.9077 | 1.13 | 9.2 |
| 60 | Neodim | Nd | 144.24 | 1.14 | 41.5 |
| 61 | Prometij | Pm | 145 | 1.13 | 2×10−19 |
| 62 | Samarij | Sm | 150,36 | 1.17 | 7.05 |
| 63 | Europij | Eu | 151.964 | 1.2 | 2 |
| 64 | gadolinij | Gd | 157.25 | 1.2 | 6.2 |
| 65 | Terbij | Tb | 158.9253 | 1.2 | 1.2 |
| 66 | disprozij | Tisti | 162.5 | 1.22 | 5.2 |
| 67 | Holmij | Za | 164.9303 | 1.23 | 1.3 |
| 68 | Erbij | je | 167.259 | 1.24 | 3.5 |
| 69 | Tulij | Tm | 168.9342 | 1.25 | 0,52 |
| 70 | iterbij | Yb | 173.04 | 1.1 | 3.2 |
| 71 | Pariz | Lu | 174.967 | 1.27 | 0,8 |
| 72 | Hafnij | Hf | 178,49 | 1.3 | 3 |
| 73 | tantal | Soočenje | 180.9479 | 1.5 | 2 |
| 74 | volfram | IN | 183,84 | 2.36 | 1.3 |
| 75 | Renij | Re | 186.207 | 1.9 | 7×10−4 |
| 76 | Osmij | Ti | 190.23 | 2.2 | 0,002 |
| 77 | Iridij | in | 192.22 | 2.2 | 0,001 |
| 78 | Platina | Pt | 195.08 | 2.28 | 0,005 |
| 79 | zlato | pri | 196,97 | 2.54 | 0,004 |
| 80 | Merkur | Hg | 200,59 | 2 | 0,085 |
| 81 | Talij | Tl | 204.3833 | 1.62 | 0,85 |
| 82 | Svinec | Pb | 207.2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bizmut | Z | 208.9804 | 2.02 | 0,009 |
| 84 | Polonij | Po | 209 | 2 | 2×10−10 |
| 85 | Astatin | pri | 210 | 2.2 | 3×10−20 |
| 86 | Radon | Rn | 222 | 2.2 | 4×10−13 |
| 87 | francij | Fr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Radij | sonce | 226 | 0,9 | 9×10−7 |
| 89 | aktinij | in | 227 | 1.1 | 5,5×10−10 |
| 90 | Torij | Th | 232.0381 | 1.3 | 9.6 |
| 91 | Protaktinij | Pa | 231.0359 | 1.5 | 1,4×10−6 |
| 92 | Uran | IN | 238.0289 | 1.38 | 2.7 |
| 93 | Neptun | Npr | 237 | 1.36 | ≤ 3×10−12 |
| 94 | Plutonij | Lahko | 244 | 1.28 | ≤ 3×10−11 |
| 95 | Americij | Am | 243 | 1.13 | – |
| 96 | Curium | Cm | 247 | 1.28 | – |
| 97 | Berkelij | kk | 247 | 1.3 | – |
| 98 | Kalifornija | Cf | 251 | 1.3 | – |
| 99 | Einsteinij | je | 252 | 1.3 | – |
| 100 | Fermij | Fm | 257 | 1.3 | – |
| 101 | Mendelejev | Md | 258 | 1.3 | – |
| 102 | Plemeniti | št | 259 | 1.3 | – |
| 103 | Lawrencium | Lr | 262 | 1.3 | – |
| 104 | Rutherfordium | Rf | 267 | – | – |
| 105 | Dubnij | Db | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hasium | Hs | 269 | – | – |
| 109 | Meitnerij | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Rentgenij | Rg | 282 | – | – |
| 112 | Kopernik | Cn | 285 | – | – |
| 113 | Nihonij | Nh | 286 | – | – |
| 114 | Flerovij | noter | 290 | – | – |
| 115 | Moscovium | Mc | 290 | – | – |
| 116 | Livermorij | Lv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganesson | in | 294 | – | – |
Pomembni izrazi v periodnem sistemu
| Pogoji java veljavni identifikatorji | Opis |
|---|---|
| Atomsko število | Število protonov, ki sestavljajo jedro elementa, se imenuje njegovo atomsko število (Z). npr. Ogljik torej vsebuje 6 protonov, zato mora biti njegovo atomsko število samo 6. |
| Atomska masa | Opredeljena je kot povprečna masa atomov elementa. Izmeri se na podlagi relativne naravne razširjenosti izotopov elementa. Atomska masa imenujemo tudi atomska teža (A). Izmeri se v enoti za atomsko maso (amu). |
| Pika | Vodoravne vrstice od leve proti desni v periodnem sistemu se imenujejo obdobja. V periodnem sistemu je skupaj 7 obdobij. Elementi so razporejeni vodoravno zaradi podobnosti v lastnostih, kot so iste atomske orbitale in tako naprej. |
| skupina | Navpični stolpci od zgoraj navzdol v periodnem sistemu se imenujejo skupine. V periodnem sistemu je skupaj 18 skupin. Elementi so zaradi podobnosti lastnosti razporejeni navpično, saj imajo v sebi enako število valenčnih elektronov. |
| Simbol elementa | Simbol je pojem, ki se uporablja za predstavitev kemičnega elementa s črko ali kombinacijo dveh do treh črk. npr. Kemični simbol ogljika je C, medtem ko se Fe uporablja za železo in tako naprej. |
Razvrstitev elementov v periodnem sistemu
118 elementov je razvrščenih v 7 obdobij in 18 skupin, kot je prikazano zgoraj. Nadalje so elementi razdeljeni v različne bloke.
| Blokiraj | Elementi vključeni | Zapolnjena zadnja elektronska podlupina |
|---|---|---|
| s-blok | Skupina 1 (alkalijske kovine) | s-podlupina |
| Skupina 2 (zemeljskoalkalijske kovine) | ||
| p-blok | Skupina 13 (družina Boron) | p-podlupina |
| Skupina 14 (družina ogljika) | ||
| Skupina 15 (družina dušika) | ||
| Skupina 16 (družina kisika) | ||
| Skupina 17 (družina fluora) | ||
| d-blok | Skupine od 3 do 12 (Prehodni elementi) | d-podlupina |
| f-blok | Lantanidi (redki zemeljski elementi) | f-podlupina |
| Aktinidi |
Mendelejev periodni sistem
Da bi predstavil podobnosti in trende v obnašanju elementov, je Mendelejev razvil periodični sistem, ki je razporeditev elementov v vrstnem redu naraščajoče atomske mase v obliki tabele.

V skladu z Mendelejevim periodnim sistemom so bili elementi razvrščeni glede na njihove temeljne lastnosti, atomsko maso in kemijske značilnosti. V času Mendelejeva je bilo znanih le 63 elementov. V periodnem sistemu Mendelejeva so vodoravna vrstica in navpični stolpci označeni kot skupine oziroma obdobja.
Vendar pa Mendelejev periodni sistem ne uspe zaradi številnih napak v njem. Nekateri od njih so, da v njem ni uspelo označiti vodika in žlahtnih plinov. Tudi naraščajoči vrstni red atomske mase elementov ni bil pravilen v celotni tabeli. Celo odkritje izotopov krši Mendelejev periodični zakon.
Preberi več:
- Sodobni periodni sistem
- Mendelejev periodični sistem
- Sodobno periodično pravo
- Zgodovina periodičnega sistema
- Atomska zgradba
Pogosta vprašanja o periodnem sistemu elementov
Kaj je periodni sistem elementov?
Periodni sistem elementov je tabelarična razporeditev kemičnih elementov, organiziranih glede na njihovo atomsko število, konfiguracijo elektronov in ponavljajoče se kemične lastnosti. Tabela je razdeljena na vrstice, imenovane obdobja, in stolpce, imenovane skupine ali družine.
Kdo je odkril periodni sistem elementov?
Periodičnega sistema elementov ni odkril en sam človek, ampak za njegov razvoj je zaslužen Dmitrij Mendelejev, ruski kemik, ki je leta 1869 razporedil elemente na podlagi njihovih lastnosti.
Kdo je izdelal moderni periodni sistem?
Leta 1913 je Henry Moseley predstavil posodobljeno različico periodnega sistema, ki se običajno imenuje sodobni periodni sistem.
Kako je urejen periodni sistem?
Periodni sistem je urejen po naraščajočem atomskem številu, pri čemer so elementi združeni na podlagi podobnih kemijskih lastnosti in razvrščeni v obdobja (vrstice) in skupine (stolpci).
Kaj je atomsko število?
Število protonov, ki sestavljajo jedro elementa, se imenuje njegovo atomsko število (Z). npr. Ogljik torej vsebuje 6 protonov, njegovo atomsko število mora biti samo 6.
Ali imata lahko dva različna elementa enako atomsko število?
Število nevtronov v atomu dveh različnih elementov je lahko podobno, vendar število protonov ne bo nikoli enako. Vsak element ima določeno število protonov, ki ustreza številu atomov.
Kako izračunati atomsko maso?
Atomsko maso lahko izračunamo tako, da seštejemo maso protonov in nevtronov v elementu.
Kaj je skupina v periodnem sistemu?
Stolpec v periodnem sistemu se nanaša na skupino periodnega sistema. Elementi iste skupine imajo podobne fizikalne in kemijske lastnosti.
