Aufbaujev princip je osnovna metoda, ki nam pove, kako so elektroni napolnjeni v atomski orbitali. V skladu z Aufbaujevim načelom sledi polnjenje elektronov v osnovnem stanju atoma osnovnemu vzorcu. To načelo nam pove, da so elektroni v atomski orbitali katerega koli atoma zapolnjeni v naraščajočem vrstnem redu njihove energije in za iskanje energije atomske orbitale sledijo pravilu n+l.
Načelo strukture
V tem članku bomo podrobno spoznali načelo Aufbau, značilnosti načela Aufbau, njegove izjeme in omejitve.
Opredelitev načela strukture
Aufbaujevo načelo pravi, da
Elektroni v različnih orbitalah se polnijo v naraščajočem vrstnem redu glede na njihovo energijo, tj. orbitala z najmanjšo energijo bo napolnjena prva in orbitala z največjo energijo bo napolnjena zadnja.
Beseda 'Aufbau' v nemščini pomeni 'graditev'. Tvorba orbital pomeni polnjenje orbital z elektroni. Navaja, da so elektroni v atomskih orbitalah zapolnjeni v naraščajočem vrstnem redu energije atomske orbitale. Energija atomske orbitale se izračuna z uporabo pravila n+l, ki določa, ali ima elektron z višjim številom vrednosti n+l večjo energijo. V pravilu, obravnavanem v prejšnji vrstici, n pove Glavno kvantno število in l pove azimutno kvantno število.
Če imata dva elektrona enako vrednost n+l, potem je elektron z manjšo vrednostjo n ima manjšo energijo in se najprej napolni. Vrstni red zapolnjevanja elektronov v atomski orbitali je obravnavan spodaj.
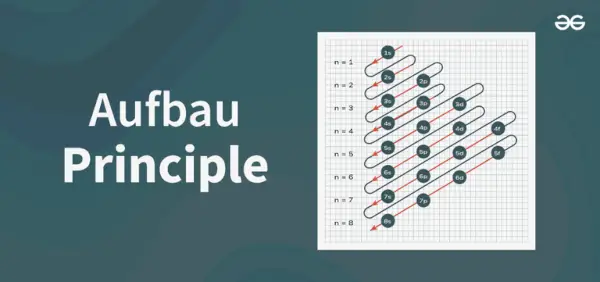
Struktura načelnega diagrama
Aufbaujev principijelni diagram je diagram, ki prikazuje vrstni red polnjenja elektronov v atomu.
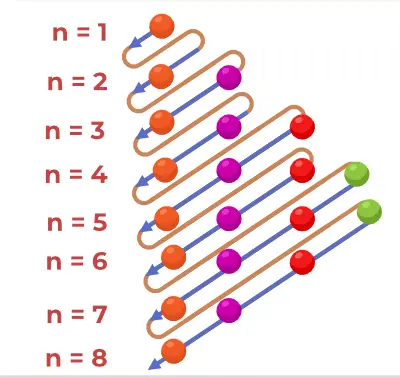
Struktura načelnega diagrama
Struktura glavne formule
Aufbaujeva načelna formula je formula, ki pove vrstni red, v katerem so elektroni zapolnjeni v atomski orbitali. Formula atomske orbite je
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Struktura glavnega razreda 11
Načelo Aufbau je pomembno načelo kemije za učence v 11. razredu. To načelo pravi, da
Elektroni v atomski orbitali atoma so zapolnjeni v naraščajočem vrstnem redu glede na energijo atomske orbitale, ki je izračunana s pravilom (n+l).
Risanje strukturnega diagrama
Diagram Aufbau je narisan z uporabo spodaj dodanih korakov,
- Poiščite število elektronov, ki jih je treba zapolniti v atomih.
- Vemo, da je v atomu
- s-orbitala lahko zadrži največ 2 elektrona.
- p-orbitala lahko zadrži največ 6 elektronov.
- d-orbitala lahko zadrži največ 10 elektronov.
- f-orbitala lahko zadrži največ 14 elektronov.
- Zapolnite prva dva elektrona v orbitali 1s.
- Nato sledite pravilu n+l in nato ustrezno napolnite elektrone.
Glavne značilnosti načela strukture
Različne značilnosti načela Aufbau so,
- Energija orbitale je odvisna od vsote vrednosti glavnega kvantnega števila (n) in azimutnega vsotnega števila (I). To se imenuje (n + l) pravilo . Po tem pravilu je
- V nevtralnem izoliranem atomu je manjša kot je vrednost (n + l) za orbitalo, nižja je njegova energija. Če pa imata dve različni vrsti orbital enako vrednost (n + l), potem imajo orbitale z nižjo vrednostjo n manj energije.
| Vrsta orbite pretvorite niz v datum | Vrednost n | Vrednost l | Vrednost n+l | Relativna energija |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Najnižja energija |
| 2s poskusite strukturo podatkov | 2 | 0 | 2+0 = 2 | Višja energija kot 1s orbitala |
| 2p 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p orbitale (n=2) imajo nižjo energijo kot 3s (n=3) orbitale. |
| 3p 4s | 3 4 | 1 0 | 3+1 = 4 dodajte v matriko v Javi 4+0 = 4 | 3p orbitale (n=3) imajo nižjo energijo kot 4s (n=4) orbitale. |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d orbitale (n=3) imajo manjšo energijo kot 4p(n=4) orbitale. |
Iz opisa v tabeli sledi, da energije različnih orbital naraščajo z naraščanjem števila glavnega kvantnega števila.
- Tako je vrstni red, v katerem so elektroni zapolnjeni v atomski orbitali atom je, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Elektronska konfiguracija z uporabo principa Aufbau
The elektronska konfiguracija Uporaba načela Aufbau za nekaj elementov je obravnavana spodaj:
Elektronska konfiguracija žvepla
Atomsko število žvepla je 16, kar pomeni, da ima 16 elektronov
Z uporabo načela Aufbau je elektronska konfiguracija žvepla zapisana kot
[S] = 1s 2 2s 2 2p 6 3s 2 3p 4
Elektronska konfiguracija dušika
Atomsko število dušika je 7, kar pomeni, da ima 7 elektronov
Z uporabo načela Aufbau je elektronska konfiguracija dušika zapisana kot
[N] = 1s 2 2s 2 2p 3
Izjeme od načela strukture
Obstaja nekaj izjem od načela Aufbau, ki sta krom in baker. Njihova elektronska konfiguracija je,
Elektronska konfiguracija Chromiuma
Elektronska konfiguracija Chromiuma v skladu z načelom Aufbau bi morala biti
- Cr(24): [Ar]3d 4 4s 2
Toda zgornja konfiguracija ni pravilna, ker je dejanska elektronska konfiguracija Chromium(Cr)
- Cr(24): [Ar]3d 5 4s 1
Razlog za to elektronsko konfiguracijo je, da napol zapolnjena d-atomska orbitala je bolj stabilna kot orbitala, zapolnjena po Aufbaujevem principu.
Elektronska konfiguracija bakra
Elektronska konfiguracija bakra v skladu z načelom Aufbau bi morala biti,
- Cu(29): [Ar]3d 9 4s 2
Zgornja konfiguracija ni pravilna, ker je dejanska elektronska konfiguracija bakra (Cu),
- Cu(29): [Ar]3d 10 4s 1
Razlog za to elektronsko konfiguracijo je, da polno zapolnjena d-atomska orbitala je bolj stabilna kot orbitala, zapolnjena po Aufbaujevem principu.
Preberi več
- Kvantna števila
- Oblika atomskih orbital
- Atomska zgradba
Načelo strukture – pogosta vprašanja
Kaj je načelo Aufbau v kemiji?
Načelo Aufbau v kemiji je osnovno načelo, ki se uporablja za zapolnitev elektronov v atomskih orbitalah katerega koli atoma. Ta izrek nam pove, v kakšnem vrstnem redu so elektroni zapolnjeni v atomski orbitali.
vadnica za pyspark
Kdo je dal načelo Aufbau?
Aufbaujev princip je dal slavni danski fizik Niels Bohr leta 1920.
Kaj je Paulijevo načelo izključitve?
Paulijevo izključitveno načelo pravi, da v atomu nobena dva elektrona nimata vseh štirih kvantnih števil t on isti. Vsaj eno od kvantnih števil je različno za vse elektrone v atomu.
Kaj je pravilo n+l?
Pravilo n+l je pravilo, ki pravi, da je energija orbitale odvisna od vsote glavnega kvantnega števila (n) in azimutnega kvantnega števila (l). to pravilo se imenuje (n+l) pravilo.
Katere so izjeme od načela Aufbau?
Izjeme od načela Aufbau so,
- Elektronska konfiguracija kroma Cr[24]
- Elektronska konfiguracija bakra Cu[29]
