Koncept hibridizacija je definiran kot postopek združevanja dveh atomskih orbital, da se ustvari nova vrsta hibridiziranih orbital. To medsebojno mešanje običajno povzroči nastanek hibridnih orbital s popolnoma različnimi energijami, oblikami itd. Hibridizacijo izvajajo predvsem atomske orbitale iste energijske ravni. Vendar pa lahko v tem procesu sodelujejo tako popolnoma zapolnjene kot napol zapolnjene orbitale, če sta njuni energiji enaki. Koncept hibridizacije je razširitev teorije valenčne vezi, ki nam pomaga razumeti nastanek vezi, energije vezi in dolžine vezi.
vrstico in stolpec
Kaj je hibridizacija?
Ko se dve atomski orbitali združita, da tvorita hibridno orbitalo v molekuli, se energija orbital posameznih atomov prerazporedi, da dobimo orbitale z enakovredno energijo. To je znano kot hibridizacija.
Atomske orbitale primerljivih energij se pomešajo med postopkom hibridizacije, ki večinoma vključuje združitev dveh orbital ali dveh 'p' orbital ali mešanje 's' orbitale s 'p' orbitalo in tudi z 's' orbitala z 'd' orbitalo.
Hibridne orbitale so nove orbitale, ki nastanejo kot rezultat tega procesa. Še pomembneje je, da se lahko hibridne orbitale uporabijo za razlago lastnosti atomske vezi in molekularne geometrije. Ogljik na primer tvori štiri enojne vezi, v katerih se orbitala s valenčne lupine združuje s tremi orbitalami p valenčne lupine. Ta kombinacija ustvari štiri enakovredne sp3mešanice. Ti bodo razporejeni v tetraedričnem vzorcu okoli ogljika, ki je vezan na štiri različne atome.
Koraki za določitev vrste hibridizacije
Da bi razumeli vrsto hibridizacije v atomu ali ionu, je treba upoštevati naslednja pravila.
- Najprej določite skupno število valenčnih elektronov, ki jih vsebuje atom ali ion.
- Nato preštejte število osamljenih parov, pritrjenih na ta atom ali ion.
- Zdaj lahko število potrebnih orbital izračunamo tako, da seštejemo število dupleksov ali oktetov in število osamljenih parov elektronov.
- Upoštevati je treba, da je geometrija orbital v atomih ali ionih drugačna, če ni osamljenega para elektronov.
Značilnosti hibridizacije
- Hibridizacija se pojavi med atomskimi orbitalami z enakimi energijami.
- Število nastalih hibridnih orbital je enako številu atomskih orbital, ki se mešajo.
- Ni potrebno, da vse napol zapolnjene orbitale sodelujejo pri hibridizaciji. Sodelujejo lahko tudi orbitale, ki so popolnoma zapolnjene, vendar imajo nekoliko spremenljivo energijo.
- Hibridizacija se pojavi samo med tvorbo vezi, ne v posameznem plinastem atomu.
- Če je hibridizacija molekule znana, je mogoče predvideti obliko molekule.
- Večji reženj hibridne orbitale je vedno pozitiven, medtem ko je manjši reženj na nasprotni strani vedno negativen.
Vrste hibridizacije
Hibridizacijo lahko razvrstimo kot sp3, sp2, sp., sp3d, sp3d2, ali sp3d3na podlagi vrst orbital, ki sodelujejo pri mešanju.
sp Hibridizacija
Pojavi se, ko se ena s in ena p orbitala v glavni lupini atoma združita in tvorita dve novi enakovredni orbitali. Novonastale orbitale so znane kot sp hibridizirane orbitale. Proizvaja linearne molekule pod kotom 180°. Vključuje združevanje svoje orbitale in ene 'p' orbitale enake energije, da se proizvede nova hibridna orbitala, znana kot sp hibridizirana orbitala.
- Znana je tudi kot diagonalna hibridizacija.
- Vsaka sp hibridizirana orbitala vsebuje enako količino znakov s in p.
- Vse berilijeve spojine, kot je BeF2, No2in BeCl2, so primeri.

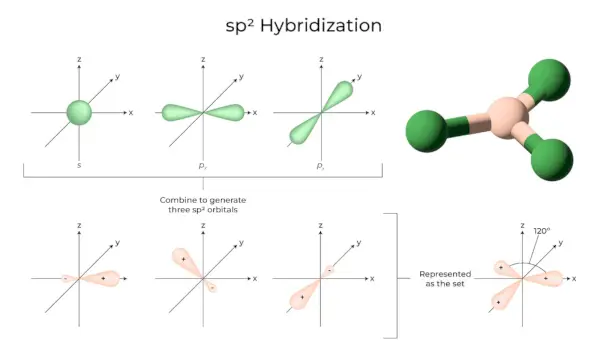
sp2Hibridizacija
Pojavi se, ko se ena s in dve p orbitali lupine istega atoma združita in tvorita tri enakovredne orbitale. Novo nastale orbitale so znane kot sp2hibridne orbitale. Znana je tudi kot trigonalna hibridizacija. Vključuje združevanje svoje orbitale z dvema 'p' orbitalama enake energije, da se ustvari nova hibridna orbitala, znana kot sp2. Mešanica trigonalne simetrije s in p orbital se ohranja pri 120 stopinjah. Vse tri hibridne orbitale ostanejo v isti ravnini in druga z drugo tvorijo kot 120°.
- Vsaka oblikovana hibridna orbitala ima 33,33 % in 66,66 % znak 'p'.
- Molekule s trikotno ravninsko obliko imajo osrednji atom, ki je povezan s tremi drugimi atomi in je sp2hibridizirana. Borove spojine so primeri.
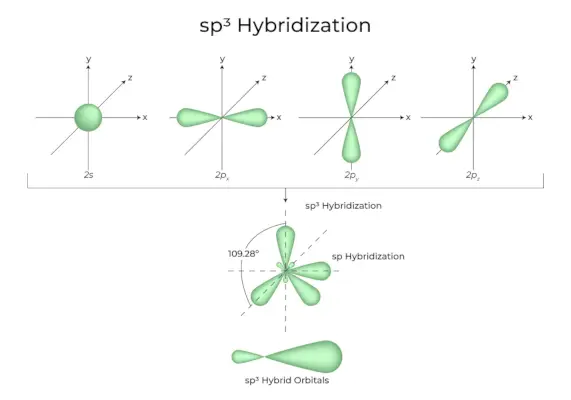
sp3Hibridizacija
Ko se ena 's' orbitala in tri 'p' orbitale iz iste lupine atoma združijo in tvorijo štiri nove enakovredne orbitale, je hibridizacija znana kot tetraedrska hibridizacija ali sp3. Novo nastale orbitale so znane kot sp3hibridne orbitale. Te so koničaste v štirih vogalih pravilnega tetraedra in med seboj tvorijo kot 109°28′.
- sp3hibridne orbitale tvorijo kot 109,28 stopinj.
- Vsaka hibridna orbitala ima 25 % s karakter in 75 % p karakter.
- Dva primera sta etan in metan.
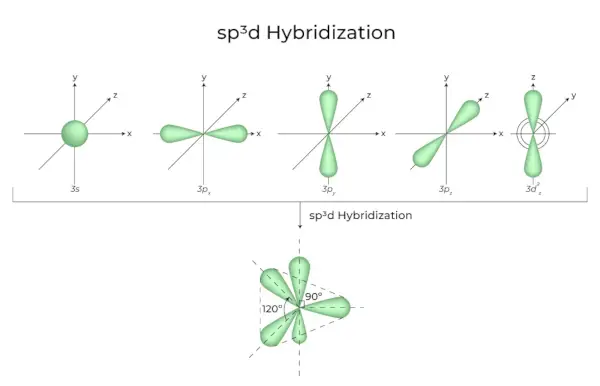
sp3d Hibridizacija
Mešanje 1s orbital, 3p orbital in 1d orbital povzroči 5 sp3d hibridiziranih orbital enake energije. Njihova geometrija je trigonalno bipiramidna. Kombinacija s, p in d orbital povzroči trigonalno bipiramidno simetrijo. Ekvatorialne orbitale so tri hibridne orbitale, ki so druga proti drugi usmerjene pod kotom 120° in ležijo v vodoravni ravnini.
- Preostali dve orbitali, znani kot aksialne orbitale, sta v navpični ravnini na ravnini 90 stopinj ekvatorialnih orbital.
- Hibridizacija v fosforjevem pentakloridu, na primer (PCl5).
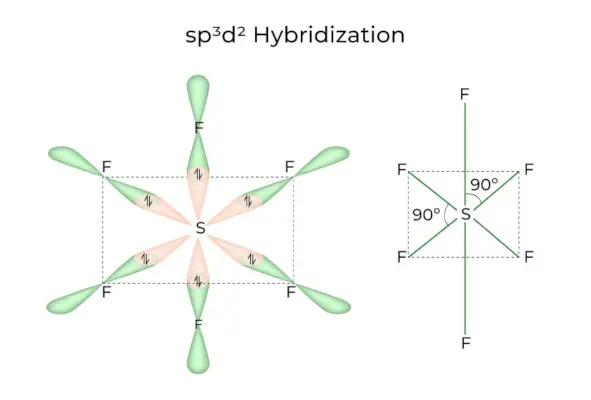
sp3d2 Hibridizacija
Ko se 1s, 3p in 2d orbitale združijo v 6 enakih sp3d2hibridne orbitale, se hibridizacija imenuje sp3d2Hibridizacija. Teh sedem orbital kaže na vogale oktaedra. Drug proti drugemu so nagnjeni pod kotom 90 stopinj.
vlc za prenos youtube
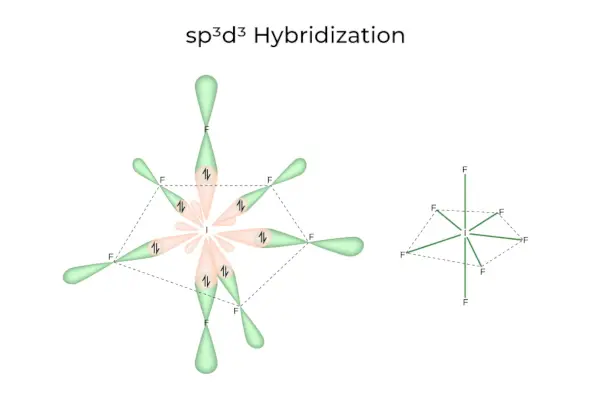
sp3d3Hibridizacija
Ima 1s, 3p in 3d orbitale, ki skupaj tvorijo 7 enakih sp3d3hibridne orbitale. Teh sedem orbital kaže na vogale peterokotne bipiramide. npr. ČE6.
Oblike hibridizacije
- Linearno : Hibridizacijo sp povzroči interakcija dvoelektronskih skupin; orbitalni kot je 180°. Trigonalna ravnina: Vključene so tri skupine elektronov, kar povzroči sp2hibridizacija; orbitali sta 120° narazen. Tetraedral: Vključene so štiri skupine elektronov, kar povzroči sp3hibridizacija; orbitalni kot je 109,5°. Trigonalno bipiramidno: vključenih je pet elektronskih skupin, kar povzroči sp3d hibridizacija; orbitalni koti so 90° in 120°. Octahedral: Vključenih je šest elektronskih skupin, kar povzroči sp3d2hibridizacija; orbitali sta 90° narazen.
Pogosta vprašanja o Hibridizacija
Vprašanje 1: Katera hibridna orbitala med sp, sp2 in sp3 je bolj elektronegativna?
odgovor:
Odstotek znaka s v sp, sp2, in sp3hibridiziranega ogljika je 50 %, 33,33 % oziroma 25 %. Zaradi sferične oblike orbitale s jo jedro enakomerno privlači iz vseh smeri. Posledično bo hibridna orbitala s-znaka bližje jedru in zato bolj elektronegativna. Posledično je sp hibridizirani ogljik najbolj elektronegativen.
Vprašanje 2: Kaj so hibridne orbitale?
odgovor:
Hibridne orbitale nastanejo z združevanjem standardnih atomskih orbital, kar povzroči nastanek novih atomskih orbital.
Vprašanje 3: Katerih je pet oblik hibridizacije?
odgovor:
pande iterrows
Linearna, trigonalna planarna, tetraedrična, trigonalna bipiramidna in oktaedrična je pet osnovnih oblik hibridizacije.
Vprašanje 4: Zakaj je molekula amida videti kot sp3hibridiziran, vendar je sp2?
odgovor:
Če je atom bodisi obdan z dvema ali več p-orbitalami ali ima osamljen par, ki lahko skoči v p-orbitalo, se bo splošni proces hibridizacije spremenil. Kot rezultat, v primeru molekule amida, osamljeni par vstopi v p orbitalo, kar povzroči tri sosednje vzporedne p orbitale.
Vprašanje 5: Kaj je Bentovo pravilo?
odgovor:
Osrednji atom, povezan s številnimi skupinami v molekuli, se bo hibridiziral, kar bo povzročilo, da bodo orbitale z večjim značajem s usmerjene proti elektropozitivnim skupinam, orbitale z večjim značajem p pa proti elektronegativnim skupinam.
